50年的蛋白质结构难题,被AI压缩到几分钟!Nature最新盘点显示,AlphaFold已被330万研究者使用。在土耳其,两位本科生借助这个免费工具完成15篇结构研究,撕开科研壁垒的裂缝。科研世界第一次以「数字速度」前进。
你有没有在实验室里,待到凌晨两点?
酶切、纯化、上机、调参数,最后盯着一条模模糊糊的条带,心里重复一句话:这要是跑不出结果,我这一年就白干了。
在地球的另一端,两名土耳其本科生也在盯着屏幕。
但他们等的,不是仪器结果,而是一个叫AlphaFold的AI模型跑出来的结构图。
后来,他们把这些结构整理成了15篇研究。
没有顶尖大牛站台,没有豪华设备清单,「核心装备」就是一个免费网页。
这不仅是一场效率革命,更像是新时代科研工作者的「超级工具使用手册」。
50年难题,被AI按下快进键
蛋白质到底长什么样?这个问题困了人类足足半个世纪。
可以把蛋白质想成细胞里的「微型复杂机器」,是生命最精密的齿轮。
它们只是由一串氨基酸排成的「线」,却要在细胞里自己折叠成精确的3D结构。
一点点折错,就有可能失去功能,甚至变成毒性沉淀,引发疾病。
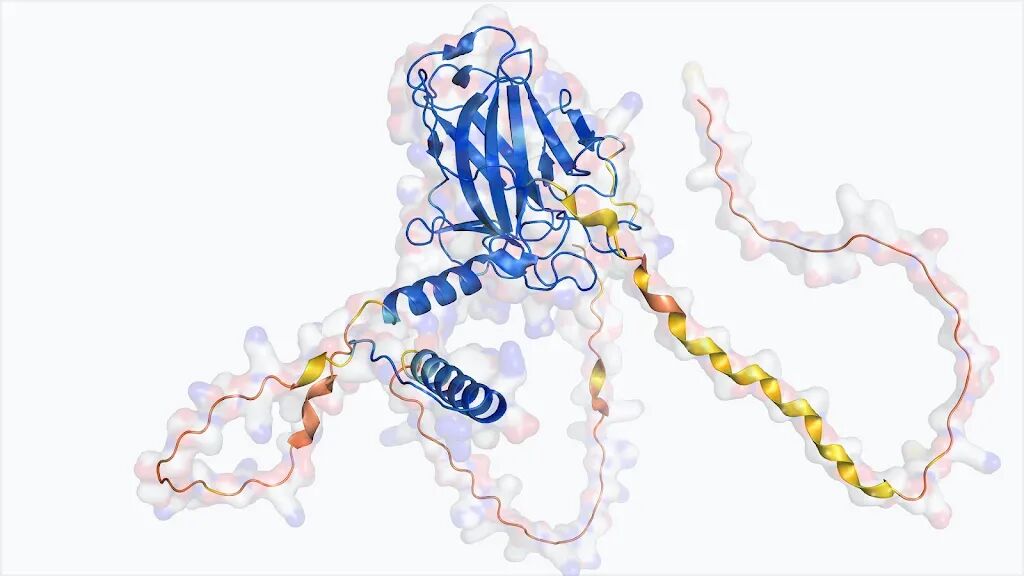
p53的AlphaFold模型结构示意图。它是AlphaFold蛋白质数据库中最受欢迎的蛋白质之一。
过去,想看清一个蛋白的3D结构,往往要花上一年甚至更久,砸进去数百万的实验成本,排队上X射线晶体仪或冷冻电镜。
科研的时间线就卡在这一步,卡了几十年。
直到2020年,AlphaFold 2在CASP14竞赛里亮相——只凭氨基酸序列,就能算出蛋白的空间结构,很多预测结果和实验图像几乎一模一样。
结构生物学家第一次意识到:原来那道堵了50年的关口,可以被AI在几分钟内算出来。
从那天开始,实验不再是唯一的入口。
个免费网页,带两名本科生闯进「黑箱」
决定改变赛局的,是DeepMind做的第二个动作:他们把AlphaFold2的代码和预测结构,直接免费丢在网上。
现在的AlphaFold蛋白质数据库里,已经有超过2亿条结构预测。

这个量级,用传统实验做,要几百万年才能慢慢累出一遍。
更关键的是:谁都能用。
Nature的统计显示,AlphaFold数据库已经被全球约330万人使用,用户遍布190多个国家,其中超过100万来自中低收入地区。
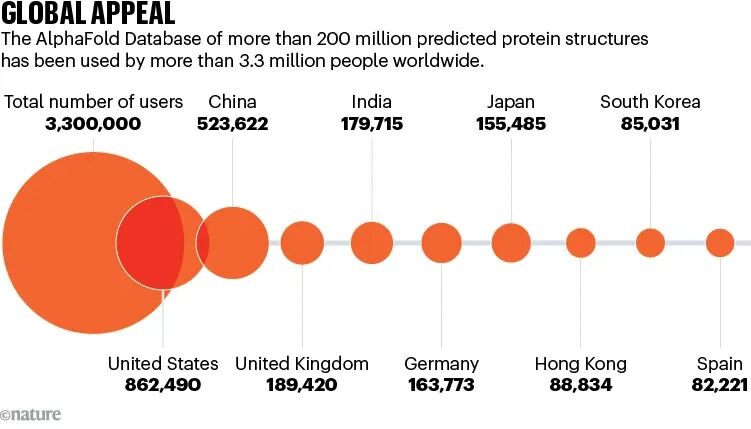
结构生物学,这个曾经极度依赖昂贵设备和少数大牛的学科,第一次有了真正意义上的「全球用户」。
对那两名土耳其本科生来说,这意味着:不需要进顶级实验室,也能直接把手伸进蛋白世界的「原子级细节」里。
他们做的事,很简单也很冒险。
把那些传统方法最难搞的膜蛋白,一个个丢进AlphaFold,看看到底能不能看清。
其中一个研究对象,是EAAT1——一个在脑细胞膜上转运神经递质的蛋白。
它像一艘潜艇,横在脂双层里,在传统实验里几乎难以捉摸,结构很难做清楚。
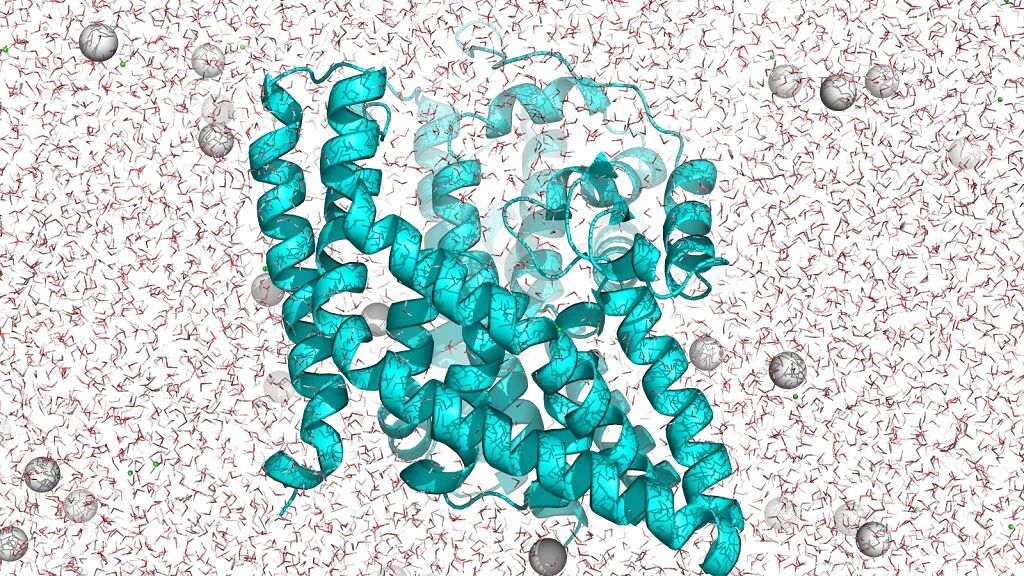
EAAT1的AlphaFold模型或类似膜蛋白结构示意图
借助AlphaFold给出的结构,这两名学生直接在3D模型上拆机重组。
他们参考膜蛋白重设计里的QTY方法,把难溶的疏水氨基酸换成更容易溶解的版本,让这艘「潜艇」在实验中更听话。
放在过去,这是一项只有顶尖分子生物学实验室才能啃的项目,要耗掉几年的试错。
现在,它更接近一次高效的计算与分析任务。
而他们并不孤单。在维也纳,Pauli团队被一个问题困了很多年:
斑马鱼卵子表面的蛋白Bouncer,到底是怎么「认出」精子的?
Nature报道了他们和AlphaFold的那次相遇。
模型预测出一个之前几乎没人注意的蛋白Tmem81,它像个夹持器一样,稳定住两种精子蛋白,为Bouncer留出一个精准的结合口袋。
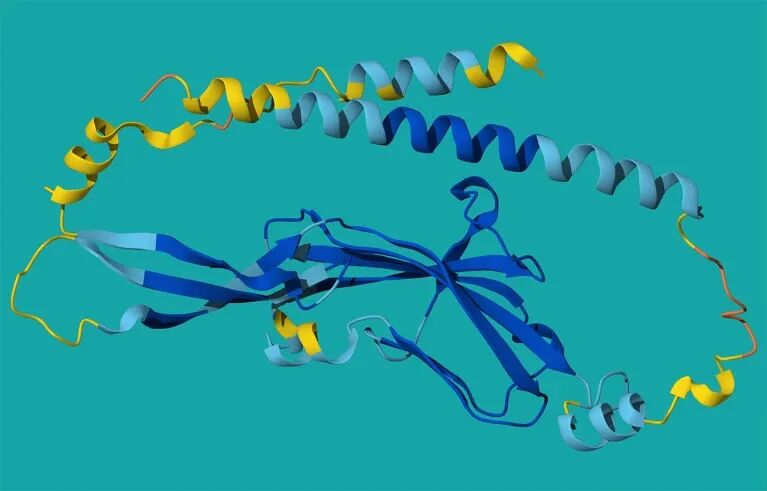
Bouncer-Tmem81复合体的示意图
后续实验一步步验证了这个结合方式,「精子如何找到卵子」这个听上去有点浪漫的问题,被拆成了一个清晰的结构故事。
Pauli后来接受采访时说了一句很直白的话:
我们现在几乎所有项目都会用AlphaFold,它让我们看到过去看不到的东西。
从摘果子到找种子:科研赛道真的变了
当结构预测变成随手可查,研究者的选题开始发生偏移。
AlphaFold帮助科学家第一次拆清了apoB100这个巨大而复杂的蛋白结构。
它在动脉粥样硬化里扮演关键角色,长期被形容成「像一个缠在一起的蛋白笼子」。

apoB100结构示意图
类似的,还有p53这样的肿瘤相关蛋白,这些靶点的结构,对药物设计和疾病机理研究都至关重要。
真正有趣的变化,出现在数据背后。
Nature汇总了大量科研记录后发现:使用AlphaFold的研究者,提交的新型蛋白质结构,比对照组高出了大约40%。
如果只看存进Protein Data Bank的实验结构,这个差距更明显:
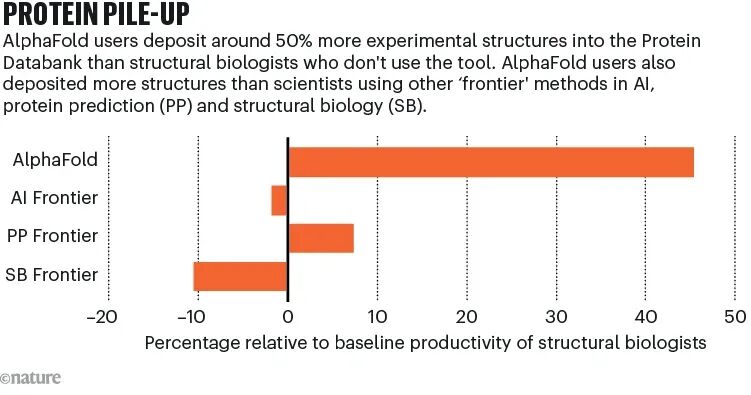
使用AlphaFold的团队,提交的结构数量,足足比不用的人多出约50%,也明显领先于其他「前沿方法」的研究者。
这意味着,AI不只是让科研做得更快,而是让更多人有能力去啃那些最难、最复杂、最没把握的结构。
Nature把这个趋势形容成一个富有诗意的句子:
结构生物学,正在从「验证区」,走向「探索区」。
更反常的是,AlphaFold自己那篇2021年的论文,引用曲线至今没有下降。
一般来说,生命科学领域的高被引论文,发表后一两年就会进入平台期甚至下滑。
但AlphaFold2那篇Nature,引用量一直在上升,滚动平均已经冲到800次以上。
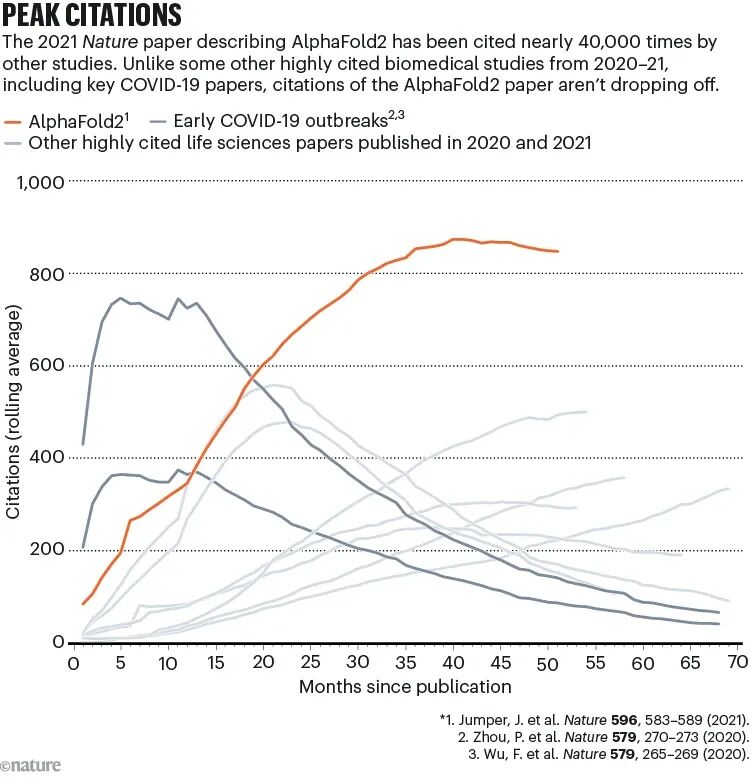
这不是一次性的「话题热度」,而是工具正在不断被新的项目复用。
统计显示,与AlphaFold2相关的研究,被临床论文引用的概率,大约是普通结构生物学工作的两倍;被专利引用的概率,也显著更高。
对很多做药物、做转化的人来说,AlphaFold作用已经不只是「看个结构图」,而是一件实实在在的生产力工具。
AlphaFold 3:画出整张生命交互图
如果说AlphaFold2解决的是「蛋白质折叠长什么样」的问题,那么AlphaFold3想解决的,是「这些分子如何彼此纠缠在一起」。
Nature的评价很直接:
这是一场从「结构预测」迈向「生命体系建模」的关键转折。
在AlphaFold3里,同一个模型可以同时看见蛋白质、DNA、RNA和小分子配体之间的相互作用。
科研人员可以看到一个候选药物是如何以3D方式卡进靶蛋白口袋里,病毒的刺突蛋白如何被糖链包裹,又如何被抗体识别。
AlphaFold 3对普通感冒病毒刺突蛋白(蓝色)与抗体(青绿色)和单糖(黄色)相互作用的结构预测与真实结构(灰色)高度吻合
这种原子级别的「全景视图」,正在被直接塞进药物设计流程。
DeepMind团队参与创立的Isomorphic Labs,正在用AlphaFold3 做AI药物发现,把这些预测转化为真实世界的候选药物。

更轻一些的应用,则出现在我们不会注意的角落里。
有人用AlphaFold解析蜜蜂体内的关键免疫蛋白Vitellogenin,指导AI辅助育种,培育更抗病的蜂群;

有人用它加速植物感知环境变化相关蛋白的研究,把原来要做上几年的假设验证,压缩到几周内初筛完毕。
从实验室到农田,从显微镜到养蜂场,AlphaFold这个「结构引擎」,正在一块块吞掉过去那些耗时耗力的环节。
回到最开始的画面:
一个是实验室里反复试错、指望实验「跑出来」的研究生;
一个是点开浏览器、把难啃的蛋白结构丢进AlphaFold的本科生。
同样是用尽全力,有的人已经在用AI把自己的时间放到最有价值的一环,有的人还在守着旧流程,希望靠熬夜换来一次突破。
AlphaFold的成功,其实给出了一个很清楚的信号——科学不再只奖赏那些「设备最多」「熬得最久」的人,而是在悄悄偏向那些最会调动工具、最敢提问的人。
对普通科研人来说,这既是压力,也是一个难得的窗口。
也许你现在没有条件去建一台冷冻电镜,也进不了DeepMind那样的实验室。
但你可以打开AlphaFold数据库,敲上自己最熟悉的那个蛋白名字,看一眼这个时代已经免费给出的「原子级蓝图」。
你会发现,有些墙真的开始松动了。
只不过,这次决定你站在墙哪一侧的,不是出身,也不是运气,而是你愿不愿意把手伸进去,按下那个「Run」的按钮。
参考资料:
https://deepmind.google/blog/alphafold-five-years-of-impact/
https://www.nature.com/articles/d41586-025-03886-9



